Descoberta que rendeu o Nobel de Medicina de 2025 revelou o “freio” do sistema imunológico e abriu caminho para imunoterapias que modulam a defesa do corpo contra tumores.
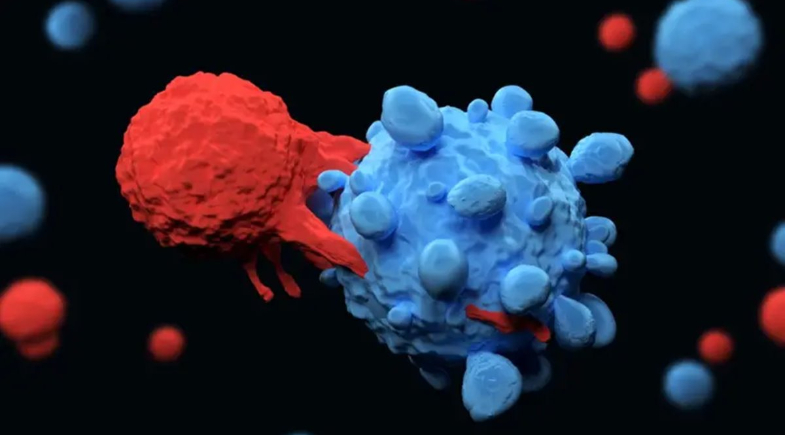
A descoberta dos mecanismos da tolerância imune periférica, que rendeu o Prêmio Nobel de Medicina 2025 a Shimon Sakaguchi, Mary Brunkow e Fred Ramsdell, vai muito além da imunologia básica. O entendimento de como o corpo evita se atacar abriu uma frente decisiva na oncologia moderna, ajudando a explicar por que certos tumores conseguem “enganar” o sistema de defesa — e como medicamentos podem reverter esse processo.
“As células T reguladoras — ou Tregs — são o coração desse equilíbrio. Elas freiam a resposta imune para impedir autoimunidade, mas, em alguns contextos, esse mesmo freio é usado a favor do tumor”, explica Stephen Stefani, oncologista do Grupo Oncoclínicas e da Americas Health Foundation.
O freio e o acelerador do sistema imune
O sistema imunológico protege o corpo eliminando microrganismos invasores e células anormais, mas precisa manter tolerância imunológica para não atacar o próprio corpo. Fora do timo, existe a tolerância periférica, controlada pelas células T reguladoras (Tregs), que funcionam como fiscais do sistema. Quando o gene FOXP3, responsável por essas células, falha, surgem doenças autoimunes graves.
Por outro lado, tumores podem explorar esse mecanismo, recrutando Tregs para se proteger do sistema imune.

Mary E Brunkow, Fred Ramsdell e Shimon Sakaguchi são anunnciados como vencedores do Prêmio Nobel de Medicina de 2025 em Estocolmo – 06/10/2025 • TT News Agency/Claudio Bresciani via Reuters
Quando o câncer aprende a se camuflar
Segundo Stefani, a descoberta das células T reguladoras (Tregs) e do FOXP3 ajudou a entender como certos cânceres, como pâncreas e pulmão de pequenas células, escapam da vigilância imunológica.
A densidade de Tregs no tumor é estudada como biomarcador de resposta à imunoterapia. Em alguns cânceres, como o de cólon, altos níveis de Tregs se associam a melhor prognóstico, enquanto em outros indicam resistência ao tratamento.
“No câncer, há um aumento desses freios, incluindo as Tregs, o que permite que os tumores escapem da vigilância imunológica. Já nas doenças autoimunes, acontece o oposto — há uma deficiência dessas células”, explica Cristina Bonorino.
Imunoterapia de ponta
Essa compreensão inspirou terapias baseadas na regulação imunológica. Ao modular as Tregs, pesquisadores buscam restaurar o equilíbrio — ativando a imunidade contra o câncer ou silenciando-a em doenças autoimunes.
O campo da imunoterapia, especialmente com inibidores de checkpoint como anti-PD-1 e anti-CTLA-4, se beneficia dessas descobertas, liberando os “freios” do sistema imune e permitindo que as células T ataquem o tumor.
Ensaios clínicos tentam inibir Tregs nos tumores para potencializar imunoterapias. Fármacos como sorafenibe, sunitinibe e anticorpos anti-CCR4 (ex.: mogamulizumabe) são promissores. Modular Tregs visa restaurar equilíbrio imunológico, ativando a imunidade contra o câncer ou silenciando-a em doenças autoimunes.
Novas terapias a partir da descoberta
A descoberta de Tregs e do gene FOXP3 abriu novas terapias imunológicas em testes clínicos. Pesquisas buscam modular esse “freio biológico” para ativar a imunidade contra câncer ou em doenças autoimunes e transplantes.
Entre os estudos estão mogamulizumabe (elimina Tregs no tumor) e camidanlumabe (testado em linfomas). Versões modificadas da interleucina-2 estimulam Tregs de forma controlada, com resultados promissores em diabetes tipo 1 e doenças inflamatórias intestinais.
Próximo passo: terapias sob medida
Na era da oncologia de precisão, a compreensão dos mecanismos de tolerância periférica permite sonhar com terapias personalizadas, em que o grau de resposta imune possa ser ajustado conforme o tipo de tumor e o perfil genético do paciente.
“Ainda é cedo para dizer qual câncer se beneficiará mais, mas o caminho está aberto. A imunologia, que começou com um Nobel voltado à autoimunidade, agora oferece chaves para tratar também o câncer”, resume Stefani.











Adcionar comentário